根本 孝裕
教授/PI
大阪大学ヒューマン・メタバース疾患研究拠点
- 関連ウェブサイト:
- research gate researchmap X(Twitter) 個人ウェブサイト
PRIMeの研究者
PRIMeでは、多様な分野、国籍、背景を持つ研究者がアンダーワンルーフで混ざり合い、学際的・統合的な研究ができる研究環境を醸成していきます。

数理モデルとオルガノイド実験の間のフィードバック
数理モデルと実験結果との間の密接なフィードバックはデジタルツインに欠かせません。私たちのグループでは、実験を行っているグループと慎重に議論しながら、ヒューマンメタバースを作るために必要なビルディングブロックとなるアルゴリズムを開発していきます。現在の目標の一つは、ヒトオルガノイド実験データを使ってファインチューニングされた多遺伝子リスクスコア(PRS)を開発することです。
研究概要
過去の研究
アルゴリズム開発とデータ解析:データ解析では、データを(実験やフィールドワークなどを通して)実際に収集する人と密接に議論し、問題に対して適切なアルゴリズムを提案することが重要になります。流体力学1、生物物理学2、疫学3、バイオインフォマティクス4など、さまざまな学際領域で緊密なコラボレーションを我々はこれまで行ってきました。例えば、フランス領ポリネシアは太平洋にある美しい熱帯の国ですが、デング熱などの蚊が媒介する病気に悩まされています(図(A))。デング熱は一度目の感染では症状が軽く、二度目の感染で重度の症状を示すこと(抗体依存性感染増強)が知られています。そのため、得ることの困難な報告されていない患者数を見積もることが、今後起こり得るエピデミックの規模を予測するために重要になります。デング熱の患者データを30年以上集めている島の研究チームと協力し、彼らとの長期にわたる議論を通じてこの状況を改善するアルゴリズムを我々は提案しました。このアルゴリズムでは、実際に観測された患者の分布から、観測されなかった患者数分布を見積もります[3]。
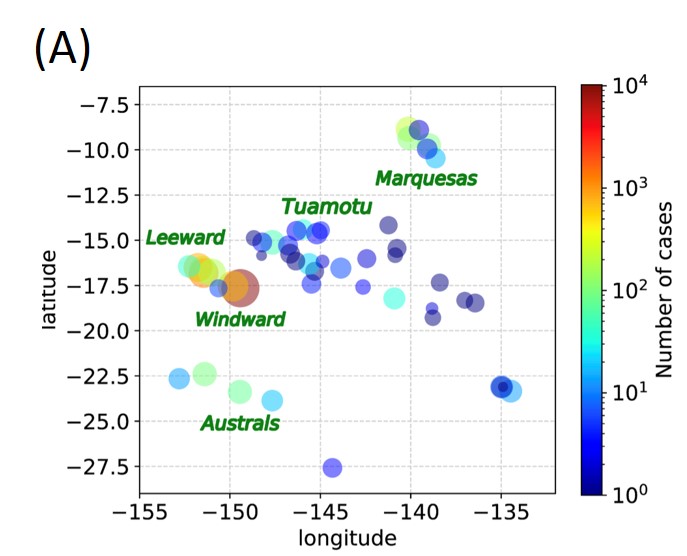
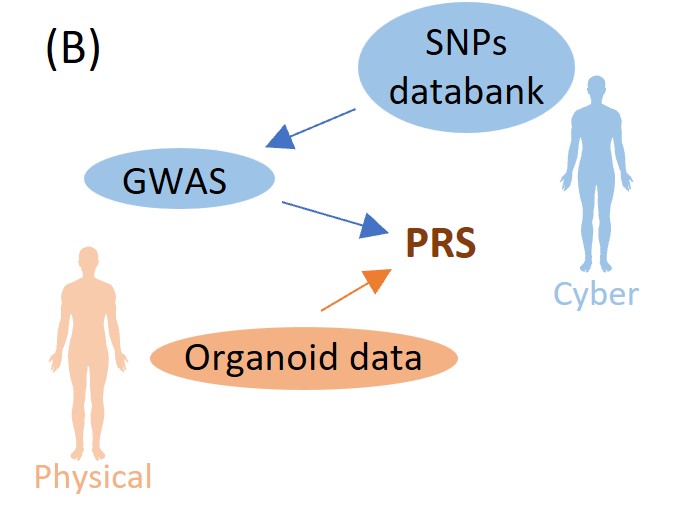
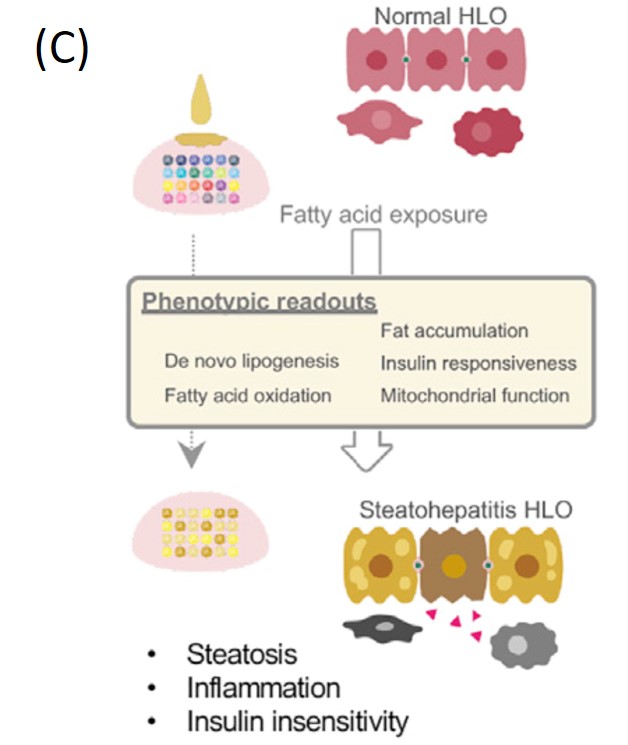
図 フランス領ポリネシアのデング熱患者分布(A)3、オルガノイド実験によるPRSのキャリブレーション(B)、肝臓オルガノイドの脂肪蓄積実験(C)5。
研究計画
臨床現場において各患者ごとにヒトオルガノイドを合成するのは非現実的です。ヒトデジタルツインにおいて、ヒトオルガノイドの実験結果を反映した、(実際にその患者に対してオルガノイド実験を行わずに計算できる)患者の「リスクスコア」の導入は不可欠です。ゲノムワイド関連解析(GWAS)では、一塩基変異に対する効果量が同定されますが、この結果から、各患者の疾患リスクを表す多因子リスクスコア(PRS)を計算することが出来ます。基本的なアイデアとしては、各患者が持つ遺伝的変異についてGWASで得られた効果量を足し合わせたものがPRSです。実際にはGWASで得られた効果量などの要約統計量に加えて、標的となるデータセットを用いてPRSを標的に応じて計算します。(例えば、標的に応じて考える遺伝的変異の数を減らす”clumping/pruning and thresholding”法や、異なる変異間に相関構造を導入するベイズ型LDpredなどの手法です。)これと同様にして、ヒトのオルガノイド実験データを標的として、PRSを計算する計画を立てています(図(B))。これは、武部教授らと密接に連携しながら進めており、肝臓オルガノイドの脂質蓄積実験のデータ(図(C))を使用する予定です5。
参考文献